İlaçları Hızlı Bir Şekilde Test Eden Cihaz Geliştirildi

Massachusetts Teknoloji Enstitüsü (MIT) ve Draper araştırmacıları, biyopsi yapılmış tümör dokusunda kanser tedavilerini simüle edebilen yeni mikroakışkan cihazdan üç boyutlu baskı yaptı. Yani bu demek oluyor ki, klinisyenler tek bir dozun uygulanmasından önce hastaların farklı tedavilere nasıl tepki vereceğini daha iyi inceleyebilirler.
Günümüzde kanser tedavilerini test etmek çoğunlukla deneme yanılma yöntemine dayanır; hastalar işe yarayan bir tedavi peşinde çok fazla zaman harcayabilirler. Farmasotik gelişimindeki son yenilikler belirli kanser tiplerinde ilaçları test etmek için yapay tümörlerin büyümesini gerektirir. Ancak bunların büyümesi haftalar alır ve hastanın biyolojik yapısını hesaba katmaz, bu da tedaviyi olumsuz etkileyebilir.
Cihaz, yüzeyden yükselen üç silindirik baca ve bir çip ile yaklaşık bir saat içerisinde baskı yapabilir. Silindirik bacalar, sıvıların girişinde ve boşaltılmasında görev almakla birlikte istenmeyen hava kabarcıklarını da önleyen portlardır. Biyopsi yapılmış tümör parçaları, dokuya sıvıları ileten kanalların bir ağına bağlı bölmeye yerleştirilir. Klinisyenler, dokunun ilaçlara karşı tepkisini görmek için çeşitli görüntüleme tekniklerini kullanabilirler.
Önceki 3D baskılı mikroakışkan cihazlar, ilaç testi için umut vaat ederken reçinelerindeki kimyasal maddeler genellikle hücreleri hızlı bir şekilde öldürdü. Araştırmacılar, cihazlarını gösteren ve tümör analiz platformu (TAP) olarak adlandırılan tümör dokusunun yüzde 90’ından fazlasını en az 72 saat canlı tutan floresan mikroskobu görüntülerini yakaladılar.
Üç boyutlu baskı yapan cihazın kolay ve ucuz bir şekilde üretilebilmesinden dolayı araştırmacılar, en kısa sürede klinik ortamlarda uygulanmaya başlamasını bekliyorlar. Cihazın kullanılmasıyla birlikte doktorlar, tek bir hasta için aynı anda tümör parçaları ve farklı ilaçlar arasındaki etkileşimlerin modellenmesini mümkün kılabilen çeşitli tümör örneklerini destekleyebilecek sayısız cihaz yazdırabilir.
Luis Fernando Velasquez-Garcia, “Kanser hastası olan bir birey için biraz doku alıp cihazımızda tümörü canlı tutabilir, birden fazla test yapabilir ve hastada işe yarayan en iyi tedaviyi bulup uygulayabilirsiniz.” şeklinde açıklama yaptı. Velasquez-Garcia, Mikrosistem Teknoloji Laboratuvarı’nda araştırmacı ve Mikroelektromekanik Sistemler Dergisi’nin Aralık sayısında yer alan, cihazı açıklayan bir makalenin ortak yazarıdır.
Bu cihaz, immünoterapiyi test etmek için umut veren bir uygulamadır. Bazı ilaçlarla hastanın kanserle savaşmasına yardımcı olmak için bağışıklık sistemini iyileştiren yeni bir tedavi yöntemidir. İlk yazar olan Ashley Beckwith, Velasquez-Garcia’nın araştırma grubundaki yüksek lisans öğrencisidir. Ashley Beckwith, “İmmünoterapi tedavileri, kanser hücrelerinin yüzeyinde bulunan moleküler tümör işaretleyicileri hedeflemek için özel olarak geliştirilmiştir. Tedavinin sağlıklı doku üzerinde olumsuz etkileri sınırlanırken, kanser üzerinde bir saldırı yapmasına yardımcı olur. Ayrıca kanser hastalarında kimin hangi tedaviye cevap vereceğini tahmin etmek çok zordur. Cihazımız kişinin gerçek dokusunu kullanıyor, bu yüzden immünoterapi için mükemmel bir uyum sağlıyor.” şeklinde ifade etti.
Destekleyici Hücreler
Mikroakışkan cihazlar genellikle polidimetilsiloksan (PDMS) adı verilen kauçuk benzeri bir malzeme kullanılarak mikro kalıplama yoluyla üretilir. Bu teknik, canlı hücrelerdeki kanser tedavilerini taklit eden üç boyutlu ağlar oluşturmak için uygun değildir. Bunun yerine, araştırmacılar “tek parça” olarak adlandırılan bir cihaz oluşturmak için üç boyutlu baskıya yöneldiler.
Cihazın kalbi onun reçinesidir. Araştırmacılar birkaç ay boyunca reçineyle deney yaptıktan sonra Pro3dure GR-10 kullandılar. Bu malzeme dişlerin taşlanmasını önleyen ağız koruyucuları yapımında kullanılır. Cam kadar şeffaftır ve çok yüksek çözünürlükte basılabilir. Ve hücrenin canlı kalmasına olumsuz bir etkisi yoktur.
Çalışma ekibi reçineyi 96 saatlik bir sitotoksisite testine tabi tuttu. Bu test, hücreleri basılı malzemeye maruz bırakır ve meteryalin hücreler için ne kadar zehirli olduğunu ölçer. 96 saat sonra malzemedeki hücreler hala canlıydı. Velasquez-Garcia, ”Diğer reçine, malzemelerin bazılarını yazdırıyordu, ayrıca hücrelerle karışan ve onları öldüren kimyasallar yayıyordu. Test ettiğimiz yeni reçine bunu yapmıyor.” dedi.
Tuzakların Düzenlenmesi
Cihazın diğer iki önemli özelliği ise ‘kabarcık tuzağı’ ve ‘tümör tuzağı’ bulundurmasıdır. Cihaza akan sıvılar, deneyi bozabilir veya tümör dokusunu tahrip eden havayı serbest bırakan kabarcıklar oluşturabilir.
Bunu önlemek için araştırmacılar, kabarcık tuzağı oluşturdular. Bu tuzak, sıvı kanalından hava sızıntısı olan dişli porta doğru yükselen baca şeklindedir. Sıvı, tuzağa bitişik giriş deliğine enjekte edilir. İçeri girer ve tuzaktan akar, sıvıdaki kabarcıklar dişli porttan ve cihazdan dışarı çıkar. Sıvı daha sonra bir U dönüşü ile tümör yakalama bölgesine geçip, tümör parçasının içinden ve çevresinden akar.
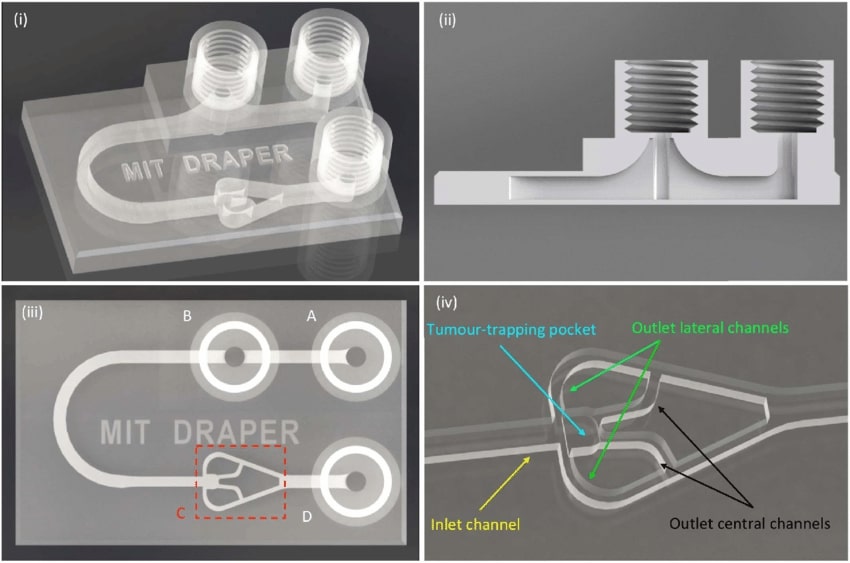
(i): tümör analiz platformunun yarı saydam 3D şeması; (ii): kabarcık tuzağının yapısı; (iii): giriş portu (A), hava kabarcığı çıkış noktası (B), tümör yakalama bölgesi (C), cihaz çıkışı (D); (iv): tümör yakalama bölgesinin giriş ve çıkış kanalları ile yakın çekimi
Tümör tuzağı bölmesi ise daha büyük giriş kanalının ve dört küçük çıkış kanalının kesişme noktasında bulunur. Tümör parçaları, giriş kanalına kabarcık tuzağı yoluyla enjekte edilir. Bu sayede enjekte sırasında ortaya çıkan kabarcıklar da önlenmiş olur. Tümör parçaları, tuzağa doğru ilerletilir. Sıvı, tümörün içine girebilmek için küçücük olan çıkış kanalları boyunca akar. Sürekli bir sıvı akışı tümör parçasını yerinde tutar ve hücreler için besinleri sürekli yeniler.
Araştırmacılar yaptıkları bu çalışma ile bir tümör parçasını canlı tutabileceklerini ve floresan belirteçlerle doku canlılığını koruyabildiklerini gösterdiler. Araştırmacıların şimdiki hedefi ise tümör parçalarının gerçek tedavilere nasıl tepki verdiğini test etmektir.
Yazar: Ayşenur Erdem
Kaynak:
MIT News, researchgate.net










